L’étude de la génétique et de la génomique en lien avec le cancer du rein a commencé à révolutionner la façon dont cette maladie est diagnostiquée et prise en charge. Le Dr Raymond Kim, M.D., Ph. D., généticien médical et directeur médical du programme Cancer Early Detection et de la clinique de cancérologie familiale Bhalwani au centre de cancérologie Princess Margaret à Toronto, a offert un aperçu de l’impact de la génétique et de la génomique sur la prise en charge du cancer du rein à l’heure actuelle, ainsi qu’un aperçu de ce à quoi nous pourrions nous attendre à l’avenir.
(en anglais ; une interprétation simultanée en français est offerte.)
Les fait saillants du webinaire
Les mutations génétiques peuvent être héritées ou acquises au cours de la vie
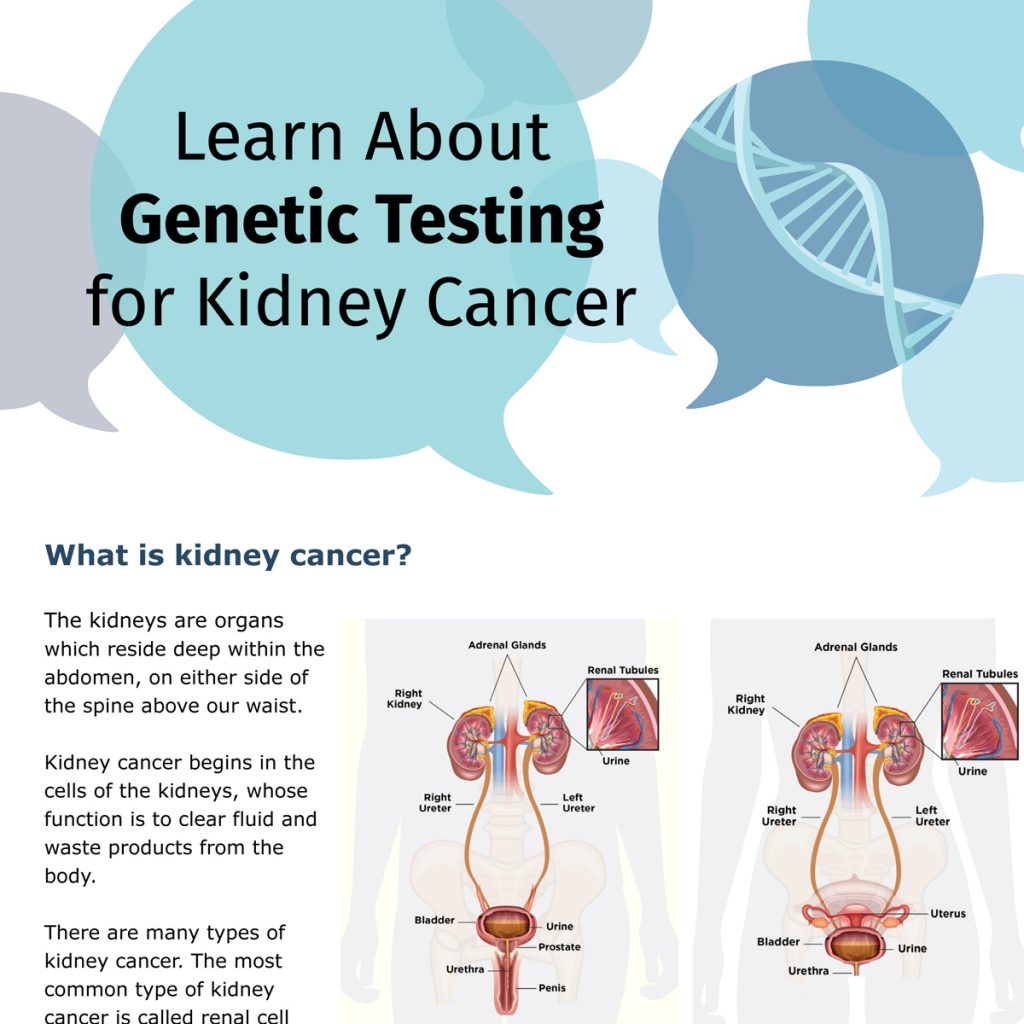
Dans le contexte du cancer du rein, la génétique fait référence à l’impact de gènes précis sur cette maladie, tandis que la génomique fait référence à l’impact de l’ensemble de notre constitution génétique sur elle. Le cancer, explique le Dr Kim, est causé par des changements génétiques, ou mutations, qui entraînent une prolifération incontrôlée des cellules. Ces mutations peuvent être héréditaires, ce qui signifie que vous êtes né avec elles, les ayant héritées de votre mère et/ou de votre père. On parle alors de mutations germinales. Vous savez probablement qu’Angelina Jolie a subi une ablation des seins pour prévenir le développement d’un cancer du sein. Elle a en effet hérité de sa mère une mutation du gène BRCA1, laquelle augmente considérablement le risque de développer un cancer du sein, un cancer ovarien, ainsi que d’autres formes de cancer. Les mutations génétiques liées au développement d’un cancer peuvent également être acquises. Le cancer du poumon, par exemple, est souvent déclenché par des mutations liées au tabagisme. Ces changements génétiques acquis sont connus sous le nom de mutations somatiques.
Le Dr Kim se spécialise dans les mutations germinales, ou héréditaires, qui augmentent la probabilité de développer certains types de cancer du rein. Il existe de nombreuses façons de déceler la présence de telles mutations. L’une d’entre elles consiste à effectuer une biopsie, c’est-à-dire à prélever un petit échantillon d’une tumeur, à examiner les caractéristiques des cellules au microscope et à effectuer des analyses génétiques afin de repérer la présence de mutations précises. Une autre méthode consiste à effectuer des analyses génétiques sur des cellules du sang ou de la peau, même si le cancer n’y est pas encore présent. En effet, les mutations génétiques présentes à la naissance peuvent se trouver dans la peau ou le sang, même si ces tissus ne sont pas actuellement touchés par le cancer.
Un test connu sous le nom de biopsie liquide est une technologie intéressante. Se trouvant toujours largement au stade exploratoire, ce test consiste à examiner les globules blancs, connus sous le nom de «couche leuco-plaquettaire» dans un échantillon de sang, à la recherche d’ADN acellulaire. Celui-ci consiste en des morceaux d’ADN qui se sont détachés de cellules mortes ou mourantes pour se retrouver dans la circulation sanguine. Étant donné que le cancer est caractérisé par la propagation rapide de cellules qui meurent rapidement pour être remplacées par un nombre croissant de cellules cancéreuses, la présence d’un cancer dans l’organisme peut se traduire par des niveaux élevés d’ADN acellulaire dans le sang. La mesure de ces niveaux peut donc aider à diagnostiquer un cancer. Lorsqu’il est répété au fil du temps, ce test peut également aider à déterminer si un patient répond bien au traitement ou s’il y a une récidive précoce, ce qui nécessiterait une reprise du traitement à la suite d’une rémission.
La détection de mutations génétiques permet d’orienter la prise en charge du cancer du rein
Il est important de déterminer le type de mutations génétiques présentes chez un patient atteint d’un cancer, puisque cela permet d’orienter le traitement. Les experts ont mis au point des thérapies précises et ciblées qui visent directement les modifications au cycle cellulaire normal résultant de mutations cancérigènes. Ce type de traitement relativement nouveau est connu sous le nom de médecine de précision; plusieurs médicaments de ce type sont utilisés aujourd’hui ou font l’objet d’essais cliniques en vue d’une utilisation future. Jusqu’à récemment, la médecine de précision s’intéressait principalement aux mutations somatiques, mais elle est de plus en plus utilisée pour les mutations germinales.
Il est aussi important de déceler les mutations, puisque leur présence offre un aperçu unique de la probabilité qu’un individu développe certains types de cancer. Cela facilite la surveillance, c’est-à-dire la planification de la fréquence à laquelle une personne doit être soumise à des imageries médicales ou à d’autres tests qui détectent la présence de cancer. Dans certains cas, une mutation germinale chez un patient atteint d’un cancer peut indiquer la nécessité de tester d’autres membres de la famille pour la même mutation.
Le Dr Kim et son équipe testent les patients admissibles pour la présence de 15 mutations génétiques qui ont été manifestement liées au cancer du rein. Ce nombre augmentera avec le temps, au fur et à mesure que de nouvelles mutations seront identifiées. Chaque province a établi des critères légèrement différents pour déterminer qui devrait subir un test génétique pour déceler la présence de gènes cancérigènes. Toutefois, en général, les facteurs suggérant la nécessité d’un tel test sont les suivants : a) diagnostic d’un cancer rare; b) diagnostic d’un type de cancer qui touche généralement les personnes plus tard dans la vie (p. ex., 10 ans plus tard); c) forts antécédents familiaux de certains cancers; d) cancers multiples chez une même personne; et e) diagnostic d’un sous-type précis de cancer étant généralement lié à des mutations génétiques.
Le Dr Kim a souligné qu’il est important de connaître la différence entre les tests génétiques de qualité médicale effectués dans des centres médicaux spécialisés et les tests génétiques disponibles en ligne, qui ne sont pas de qualité médicale, servant plutôt à des fins de divertissement qu’à l’orientation de soins médicaux. À son avis, les personnes atteintes d’un cancer qui pensent qu’elles-mêmes ou leur famille pourraient bénéficier d’un test génétique devraient en discuter avec leur oncologue. Il est presque toujours préférable de tester d’abord la personne atteinte d’un cancer avant de déterminer si un dépistage génétique doit être effectué chez les membres de sa famille, a-t-il ajouté.
Selon le Dr Kim, le dépistage génétique visant le cancer du rein est sous-utilisé au Canada et aux États‑Unis. Le processus est en cours de simplification afin que les oncologues puissent prescrire des tests génétiques eux-mêmes, au lieu de recommander le patient à un généticien. Afin de rassurer les personnes qui hésitent à subir un dépistage génétique à la suite d’une recommandation, le Dr Kim s’est penché sur les principaux mythes suivants :
- Mythe 1 : Les patients présentant des mutations génétiques liées au cancer seront confrontés à une discrimination.
Fait : Au Canada, le projet de loi S‑201 interdit aux fournisseurs de biens et de services, tels que les compagnies d’assurance vie, de pratiquer une discrimination fondée sur la génétique. De plus, les employeurs potentiels ne peuvent pas vous poser de questions sur votre statut génétique.
- Mythe 2 : Toute personne porteuse d’une mutation génétique cancérigène la transmettra à ses enfants.
Fait : Si votre partenaire n’est pas porteur de la même mutation génétique, le risque n’est que de 50 %. De plus, les embryons peuvent être modifiés pour ne pas être porteurs de telles mutations.
- Mythe 3 : Les patients doivent couvrir eux-mêmes les frais de dépistage génétique.
Fait : Si les tests sont jugés médicalement nécessaires, la plupart des provinces les couvriront. De plus, les coûts associés aux tests génétiques sont rapidement à la baisse.
- Mythe 4 : Il est tabou d’avoir des formes héréditaires de cancer.
Fait : Cela a pu être le cas auparavant, mais grâce à la sensibilisation de cette question par des célébrités telles qu’Angelina Jolie qui a rendu son histoire publique, ce tabou est en voie d’être chose du passé.
Les syndromes de cancer du rein associés à des mutations germinales sont rares mais dévastateurs
Le Dr Kim a conclu son exposé en évoquant certains syndromes du cancer du rein liés à des mutations génétiques germinales. Le terme «syndrome» fait référence à une série de caractéristiques qui se produisent ensemble. Dans chaque cas, cela comprend les caractéristiques histologiques du cancer. L’histologie du cancer se rapporte à l’aspect des cellules tumorales au microscope. Les cellules claires constituent la forme histologique la plus fréquente des cancers du rein, tandis que les histologies papillaires et chromophobes sont beaucoup moins courantes et beaucoup plus susceptibles d’être associées à des mutations germinales. Le Dr Kim a décrit les syndromes qui suivent.
- Carcinome à cellules rénales papillaire héréditaire : Ce cancer résulte d’une mutation du gène MET et peut être décelé précocement au moyen d’une imagerie abdominale. Heureusement, ces tumeurs se développent lentement et le risque de développer ce cancer diminue avec l’âge.
- Léiomyomatose héréditaire et cancer à cellules rénales (LHCCR) : Cette affection est causée par une mutation du gène FH. En plus de produire un cancer du rein papillaire, elle peut provoquer des fibromes chez les jeunes femmes, dont les symptômes peuvent être suffisamment graves pour nécessiter un traitement. Si les deux parents sont porteurs de la mutation FH et que tous deux la transmettent à leur enfant, celui-ci peut développer une maladie métabolique grave appelée déficit en fumarate hydratase.
- Syndrome de Birt-Hogg-Dubé : Ce syndrome est causé par une mutation du gène FLCN. Les personnes souffrant de ce syndrome présentent un risque accru de développer des types de cancer du rein connus sous les noms de tumeurs hybrides oncocytaires (HOT) et carcinome à cellules rénales chromophobes (chRCC). Les personnes touchées peuvent également développer des bosses en forme de dôme sur le visage, appelées fibrofolliculomes cutanés, ainsi que des kystes dans les poumons, qui peuvent se rompre et provoquer un pneumothorax, c’est-à-dire l’affaissement du poumon.
- Syndrome de Von Hippel-Lindau (VHL) : Une mutation du gène VHL expose les patients à un risque accru de cancer du rein de type carcinome à cellules claires et peut également donner lieu à des vaisseaux sanguins anormaux dans le cerveau, appelés hémangioblastomes, ainsi qu’à des kystes dans les oreilles et le pancréas, et à des tumeurs sur les glandes suprarénales. Un type de thérapie de précision composé du belzutifan est utilisé pour traiter cette affection.
- Sclérose tubéreuse complexe (STC) : Ce trouble multisystémique est causé par des mutations des gènes TSC1 et TSC2. Il peut entraîner des lésions cutanées, des kystes dans les poumons, une croissance autour des ongles, des convulsions, des tumeurs cérébrales et des tumeurs non cancéreuses dans les reins qui peuvent malheureusement se transformer en cancer. Ce syndrome est traité par une thérapie de médecine de précision utilisant l’évérolimus.
Heureusement, ces syndromes sont rares, ne touchant qu’une personne sur 20 000 à 200 000. Cette rareté les rend toutefois difficiles à étudier. Pour remédier à cette situation, le Dr Kim et son équipe au réseau de recherche ontarien sur le cancer héréditaire, ou OHCRN, élaborent plusieurs stratégies visant à rassembler les informations médicales de tous les patients touchés dans une base de données centralisée, à élaborer des lignes directrices en matière de surveillance et à promouvoir la recherche sur la meilleure façon de prendre en charge ces maladies. Étant donné qu’il existe un chevauchement considérable entre ces syndromes et les formes plus courantes de cancer du rein, cette recherche contribuera sûrement à améliorer la vie des personnes atteintes du cancer du rein, toutes formes confondues.
 RAYMOND KIM, M.D./Ph. D, FRCPC, FCCMG, FACMG
RAYMOND KIM, M.D./Ph. D, FRCPC, FCCMG, FACMG
Raymond Kim a obtenu son doctorat en médecine à l’Université de Toronto avec le Dr Tak W. Mak en biophysique médicale. Il a ensuite effectué sa résidence en médecine interne, suivi d’une formation complémentaire en génétique médicale à l’Hospital for Sick Children. Ses intérêts cliniques portent sur la transition des soins, les soins pluridisciplinaires complexes et les troubles héréditaires chez l’adulte. Ses recherches intègrent les nouvelles technologies génomiques dans les soins cliniques, notamment le séquençage du génome entier et l’ADN circulant. Il est directeur médical du Cancer Early Detection et du Bhalwani Familial Cancer Clinic du centre de cancérologie Princess Margaret. Il est également le chercheur principal de l’Ontario Hereditary Cancer Research Network de l’Institut ontarien de recherche sur le cancer et est chef du programme provincial de génétique à Santé Ontario.


 RAYMOND KIM, M.D./Ph. D, FRCPC, FCCMG, FACMG
RAYMOND KIM, M.D./Ph. D, FRCPC, FCCMG, FACMG